| 0
- 30.01.2016 - 01:21
|
Имеем аккумулятор Аком СА/СА 12V 55A, был разряжен в 0V 3 месяца. Есть шанс оживить или "труп" и не страдать "херней"? | | |
| 81
- 05.02.2016 - 03:32
| там не электролиз идет, а реакция батареи. Металл не будет выпадать в осадок. учи химию. | | |
| 82
- 05.02.2016 - 04:58
| Цитата:
Какая ещё реакция батареи? Формулу этой неизвестной науке реакции можно увидеть? | | |
| 83
- 05.02.2016 - 06:50
| Алхимики | | |
| 84
- 05.02.2016 - 07:22
| Алкохимики! | | |
| 85
- 05.02.2016 - 09:09
| Морооз покажет какая она стала батарея.. | | |
| 86
- 05.02.2016 - 09:18
| Сульфат - это соль, включает ион металла, ты куда его дел? Испариться плюмбум не мог. Сульфат вообще не распадается в этой реакции ни на что(SO4)2-, он неизменен. Воду и кислород уберите пожалуйста отсюда, нет там выделения кислорода. Иначе серу с кислотного остатка (сульфат) вы куда дели?? :)) Вот вам реакции в аккуме, изучайте: http://www.e-bike.com.ua/viewarticle/id/77/ «Таинство» преобразования энергии в аккумуляторе обеспечивает совокупность реагентов, среди которых есть окислитель и восстановитель, взаимодействующие через электролит. Восстановитель (губчатый свинец РЬ) имеет отрицательный заряд. Во время химической реакции он окисляется, и его электроны странствуют к окислителю, у которого положительный заряд. Окислитель (диоксид свинца РЬО2) восстанавливается, а результатом этого является электрический ток. В качестве электролита используют жидкость, которая плохо проводит ток, но является хорошим проводником для ионов. Это водный раствор серной кислоты (H2S04). В химической реакции происходит процесс, всем известный со школьной скамьи - электролитическая диссоциация. В процессе реакции, - положительно заряженные ионы (Н+) направляются к положительному электроду, а отрицательно заряженные ионы (SO42-) к отрицательному. Когда аккумулятор разряжается, то из восстановителя (губчатый свинец), через электролит к положительному электроду, - направляются ионы с положительным зарядом РЬ2+. Четырехвалентные ионы свинца (РЬ4+) превращаются в двухвалентные (РЬ4+). Однако, это еще не все химические реакции. Когда ионы кислотных остатков с отрицательным зарядом (SO42-) соединяются с положительно заряженными ионами свинца (РЬ2+), то на обоих электродах образуется сульфат свинца (РЬSО4). А вот это уже плохо для аккумулятора. Сульфатация сокращает срок службы аккумулятора и постепенно накапливаясь, может привести к его разрушению. Побочным эффектом химических реакций в обычных свинцово-кислотных аккумуляторах, являются газы. 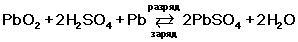 Итого нет там никакого выделения кислорода... Выделяется иногда только водород в виде побочных реакций. | | |
| 87
- 05.02.2016 - 09:35
| По химической формуле хорошо видно, что при разрядке пластины сульфатируются и из раствора уходит кислота, а остается чистая вода. Поэтому плотность падает и разряженный аккумулятор может замерзнуть при небольших морозах и вздуться. | | |
| 88
- 05.02.2016 - 09:36
| А где С2Н5ОН образовался...не вижу по формуле.. | | |
| 89
- 05.02.2016 - 09:38
| Поправил в статье валентность плюмбума, ошиблись они. 88-BIA > Я тоже, печалька... Тут электролиз, а не возгонка :) | | |
| 90
- 05.02.2016 - 09:41
| 89-прокурор >я понял.это катализатор.ускоряет реакцию....аккумуляторщика.уже внутри..бг | | |
| 91
- 05.02.2016 - 09:51
| Ага, в выхлопе - дыхнет катализатором на аккум и сразу реакция пойдет как надо. | | |
| 92
- 05.02.2016 - 14:12
|
Материал из Википедии — свободной энциклопедии Свинцово-кислотный аккумулятор. Во время разряда происходит восстановление диоксида свинца на аноде[1][2] и окисление свинца на катоде. При заряде протекают обратные реакции. При перезаряде аккумулятора, после исчерпания сульфата свинца начинается электролиз воды, при этом на аноде (положительный электрод) выделяется кислород, а на катоде (отрицательный электрод) — водород. Электрохимические реакции (слева направо — при разряде, справа налево — при заряде): Реакции на аноде: PbO_2 + SO_4^{2-** + 4 H^+ + 2 e^- \longrightarrow PbSO_4 + 2 H_2O Реакции на катоде: Pb + SO_4^{2-** - 2 e^- \longrightarrow PbSO_4 При разряде аккумулятора из электролита расходуется серная кислота и выделяется относительно более лёгкая вода, плотность электролита падает. При заряде происходит обратный процесс. В конце заряда, когда количество сульфата свинца на электродах снижается ниже некоторого критического значения, начинает преобладать процесс электролиза воды. Газообразные водород и кислород выделяются из электролита в виде пузырьков — так называемое «кипение» при перезаряде. Это нежелательное явление, при заряде его следует, по-возможности, избегать, так как при этом вода необратимо расходуется, нарастает плотность электролита и есть риск взрыва образующихся газов. Потери воды в результате электролиза восполняют доливкой в банки аккумулятора дистиллированной воды. Необходимо помнить, что вода, попадающая в концентрированную серную кислоту, закипает и сильно разбрызгивает кислотные капли. | | |
| 93
- 05.02.2016 - 14:14
| к 86 посту - Итого нет там никакого выделения кислорода... Выделяется иногда только водород в виде побочных реакций.))))) | | |
| 94
- 05.02.2016 - 14:20
|
93-Dencho > Ну если ты химию в школе прогулял, то знал бы, что получить свободный кислород в результате химической реакции не так просто. А ты говоришь об электролизе воды. А выше химики говорили, что кислород запросто так постоянно выделяется в результате обычных реакций в аккумуляторе - это крайне не верно. | | |
| 95
- 05.02.2016 - 14:22
| высшее химическое у меня ))) | | |
| 96
- 05.02.2016 - 18:53
| прокурор, спасибо за разъяснение. Возможно с кислородом я и не прав. Я представлял этот процесс так (на примере меди):  | | |
| 97
- 05.02.2016 - 18:54
| Только не понятно куда девается сера в этом примере... | | |
| 98
- 05.02.2016 - 18:56
| Усп. Перепутал Dencho с прокурор ) | | |
| 99
- 16.02.2016 - 20:25
| Вообщем, поездил на машине с этим аккумулятором, 12.02.16 снял и поставил на зарядку IMAX B6, сейчас он почти заряжен, ток прыгает 0.1-0.2А, замер плотности показывает во всех банках 1.26, так что вроде удалось его оживить | | |
| 100
- 16.02.2016 - 23:01
|
96-Есенин > сера там никуда не девается, сульфатный радикал остаётся целым в растворе. При электролизе воды гидроксид ОН- уходит, а водород остаётся Н+, фактически вместе с сульфатом образует серную кислоту. Это я разобрал приведённую реакцию, это не пример аккумулятора | | |
| 101
- 17.02.2016 - 07:47
| Купил АКБ сухозаряженый.В комплекте "кислота" в банках.Такой прям "патронтаж" спаренный.Переворачиваешь,и заливаешь.2 часа делов-и вольтметр уже показывает 12.6 в.Производство"ЕС".При детальном осмотре оказалось,что Украина. | | |
| 102
- 18.02.2016 - 17:41
|
101-BIA >Так может она уже в ЕС? Кто знает химию или физику, подскажите по губчатому свинцу - его можно превратить в негубчатый, мне надо на грузила? | | |
| 103
- 18.02.2016 - 17:58
|
Если это чистый свинец, то плавится также как и обычный. Если это оксид свинца, то фиг. Вот тут понятно все расписано: http://chem21.info/info/869363/ | | |
| 104
- 18.02.2016 - 18:10
| 103-nmu >Пробовал плавить этот губчатый свинец - ни в какую! Греется, светлеет, но не плавится, хоть тресни. | | |
| 105
- 18.02.2016 - 21:47
| 104-прокурор просил трешку > оксид свинца имеет высокую температуру плавления и вряд ли при нагреве превратится в свинец. Нужно восстановить чем-то до чистого металла | | |
| 106
- 19.02.2016 - 16:51
| 105-поздний >Вот и хотелось бы узнать, чем его восстановить. Вроде бы пишут, что губчатый свинец это не оксид свинца, а просто такое его состояние. Оксид свинца, кажется, белого цвета, диоксид красного. Ну, чем больше окисляется, тем краснее становится - до свинцового сурика. А губчатый - нормальный цвет такой, серый. | | |
| 107
- 19.02.2016 - 22:33
| 106-прокурор просил трешку >восстановить губчатый свинец в металлический можно, погугли. Только вот большая вероятность что это возможно в только в промышленных или лабораторных условиях. А так - всё можно) | | |
| 108
- 19.02.2016 - 23:01
|
А какой смысл в таком восстановлении если свинец нужен для грузил? ) Сколько там то грузило стоит, чтоб так напрягаться? | | |
| 109
- 20.02.2016 - 06:29
| 108-Есенин >Люди разные.... | | |
| 110
- 20.02.2016 - 07:10
| Губчатый свинец легко окисляется, поэтому высокотемпературная пленка оксида на поверхности не даёт ему плавиться при температуре плавления металла. Это как у алюминия | |
Интернет-форум Краснодарского края и Краснодара |